Die Änderungskontrolle ist ein wesentlicher Bestandteil des Qualitätsmanagements für Unternehmen der Medizintechnikbranche. Die ISO 13485, die internationale Norm für Qualitätsmanagementsysteme (QMS) in der Medizintechnik, legt großen Wert auf das Änderungsmanagement. Der Änderungskontrollprozess in der ISO 13485 stellt sicher, dass Modifikationen an Produkten, Prozessen oder Dokumentationen auf kontrollierte Weise umgesetzt werden. Dies trägt dazu bei, die Produktsicherheit und Wirksamkeit zu gewährleisten und gleichzeitig die Einhaltung regulatorischer Anforderungen sicherzustellen.
Dieser Artikel untersucht die Schlüsselelemente der Änderungskontrolle in ISO 13485. Wir betrachten regulatorische Rahmenbedingungen, Strategien zur Entwicklung effektiver Änderungskontrollsysteme und die Implementierung robuster Verfahren zur Änderungskontrolle. Durch das Verständnis und die Anwendung dieser Prinzipien können Fachkräfte in der Medizintechnik ihre Qualitätsmanagementsysteme optimieren und die kontinuierliche Einhaltung der ISO 13485 sicherstellen.
Lassen Sie uns eintauchen!
Regulatorische Anforderungen an die Änderungskontrolle in der Medizintechnik
The medical device industry operates under a complex regulatory framework. That framework emphasizes change control. It ensures that modifications to products, processes, or documentation are implemented in a controlled manner. That way, we can maintain product safety and efficacy while complying with regulatory requirements. The key components of this framework include ISO 13485, FDA regulations, and other applicable quality standards.

ISO 13485-Anforderungen
Die ISO 13485:2016 für Qualitätsmanagementsysteme in der Medizintechnik bietet umfassende Richtlinien zur Änderungskontrolle. Das Thema Änderung wird mehr als 30-mal erwähnt, was seine Bedeutung im Qualitätsmanagement unterstreicht.
Abschnitt 4.1.4 der ISO 13485 widmet sich explizit der Steuerung von Änderungen an QMS-Prozessen und der Einhaltung regulatorischer Änderungskontrollanforderungen.
Wichtige Aspekte der Änderungskontrolle in ISO 13485 umfassen:
- Bewertung von Änderungen hinsichtlich ihrer Auswirkungen auf das QMS und die hergestellten Medizinprodukte
- Steuerung von Änderungen gemäß der Norm und den geltenden regulatorischen Anforderungen
- Führung detaillierter Dokumentationen und Nachverfolgbarkeit jeder Änderung innerhalb des QMS
FDA-Vorschriften
Die US-amerikanische Food and Drug Administration (FDA) hat Vorschriften zur Änderungskontrolle für Medizinprodukte im Rahmen von 21 CFR Part 820, bekannt als Quality System Regulation (QSR), festgelegt. Zwar gibt es keine eigenständige Vorschrift für die Änderungskontrolle, doch wird sie in drei verschiedenen Abschnitten behandelt:
- 21 CFR 820.30(i) Design Controls
- 21 CFR 820.40(b) Document Control
- 21 CFR 820.70(b) Production and Process Changes
Diese Vorschriften verlangen, dass Medizinproduktehersteller Verfahren zur Identifikation, Dokumentation, Validierung oder Verifizierung, Überprüfung und Genehmigung von Designänderungen vor deren Umsetzung etablieren und pflegen. Zudem müssen Dokumentänderungen von geeigneten Fachkräften geprüft und genehmigt sowie Änderungsaufzeichnungen geführt werden.
Die FDA hat zwei wichtige Leitlinien veröffentlicht, um Beteiligten zu helfen, zu bestimmen, wann Modifikationen an zugelassenen Medizinprodukten eine neue Premarket Notification (510(k)) erfordern:
- Deciding When to Submit a 510(k) for a Change to an Existing Device (Leitlinie für allgemeine Modifikationen)
- Deciding When to Submit a 510(k) for a Software Change to an Existing Device (Leitlinie für Softwaremodifikationen)
Diese Leitlinien bieten einen risikobasierten Ansatz zur Bewertung, ob eine Änderung eine neue 510(k)-Einreichung erfordert, und enthalten Flussdiagramme, Beispiele sowie Empfehlungen zur ordnungsgemäßen Dokumentation von Änderungen an Medizinprodukten.
Weitere relevante Standards
Zusätzlich zu ISO 13485 und den FDA-Vorschriften beeinflussen weitere regulatorische Behörden und Standards das Rahmenwerk für die Änderungskontrolle von Medizinprodukten:
- Health Canada: Setzt auf ISO 13485:2016 zur Steuerung von Dokumentations- und Designänderungen
- Europäische Kommission: Nutzt ISO 13485:2016 und hat spezifische Anforderungen im Rahmen der Medizinprodukteverordnung (MDR) und der Verordnung für In-vitro-Diagnostika (IVDR)
- MDCG 2020-3 Rev 1: Bietet Leitlinien zur Änderungskontrolle für Medizinprodukte in der Europäischen Union
Diese regulatorischen Anforderungen betonen die Notwendigkeit eines systematischen Ansatzes zur Steuerung und Kontrolle von Änderungen an Produkten, Prozessen, Verfahren, Ausrüstungen und Systemen in der Medizintechnikindustrie.
Schlüsselelemente einer effektiven Änderungskontrolle in ISO 13485
Ein effektives Änderungskontrollsystem ist für Hersteller von Medizinprodukten entscheidend, um Produktsicherheit, Wirksamkeit und regulatorische Compliance sicherzustellen.
Dieses System gewährleistet, dass Änderungen an Produkten, Prozessen oder Dokumentationen kontrolliert umgesetzt werden. Werfen wir einen Blick auf die wesentlichen Elemente eines robusten Änderungskontrollsystems.
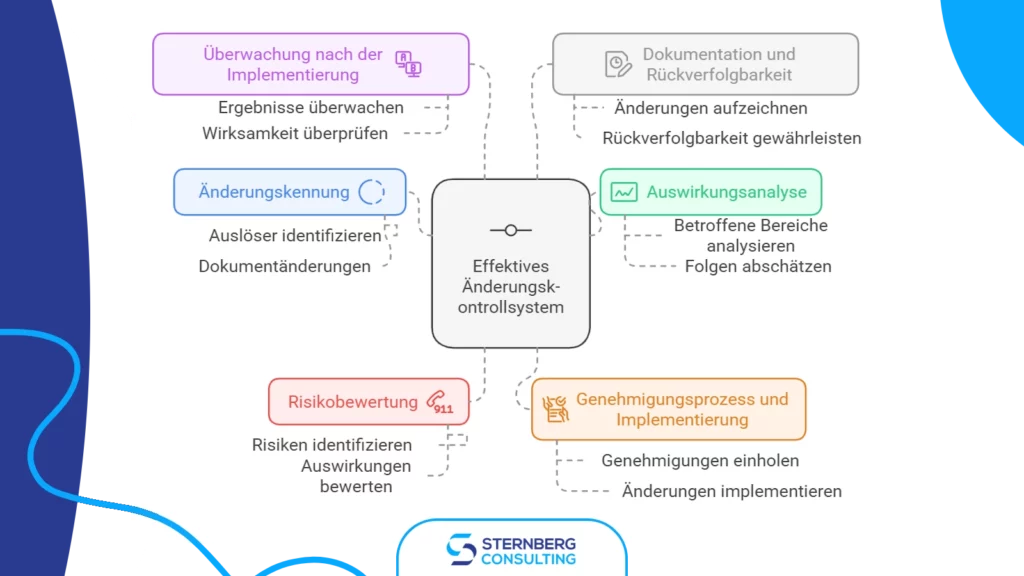
1) Identifikation der Änderung
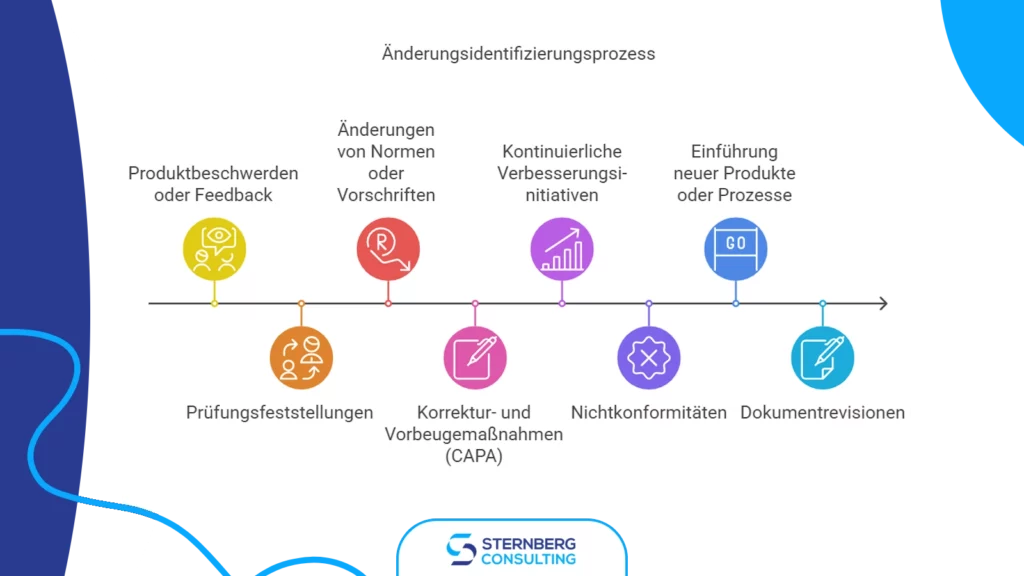
Der Änderungsprozess beginnt mit der Identifizierung des Änderungsbedarfs. Dies kann durch verschiedene Faktoren ausgelöst werden, darunter:
- Kundenbeschwerden oder Feedback
- Audit-Ergebnisse
- Änderungen in Normen oder Vorschriften
- Korrektur- und Vorbeugemaßnahmen (CAPA)
- Kontinuierliche Verbesserungsinitiativen
- Abweichungen
- Einführung neuer Produkte oder Prozesse
- Überarbeitungen von Dokumenten
Sobald ein Änderungsbedarf festgestellt wird, erfolgt die Dokumentation in einem Änderungsformular. Dieses sollte Details wie Begründung, Ziele und betroffene Bereiche enthalten, um eine systematische Bewertung und Umsetzung zu ermöglichen.
2) Auswirkungenanalyse
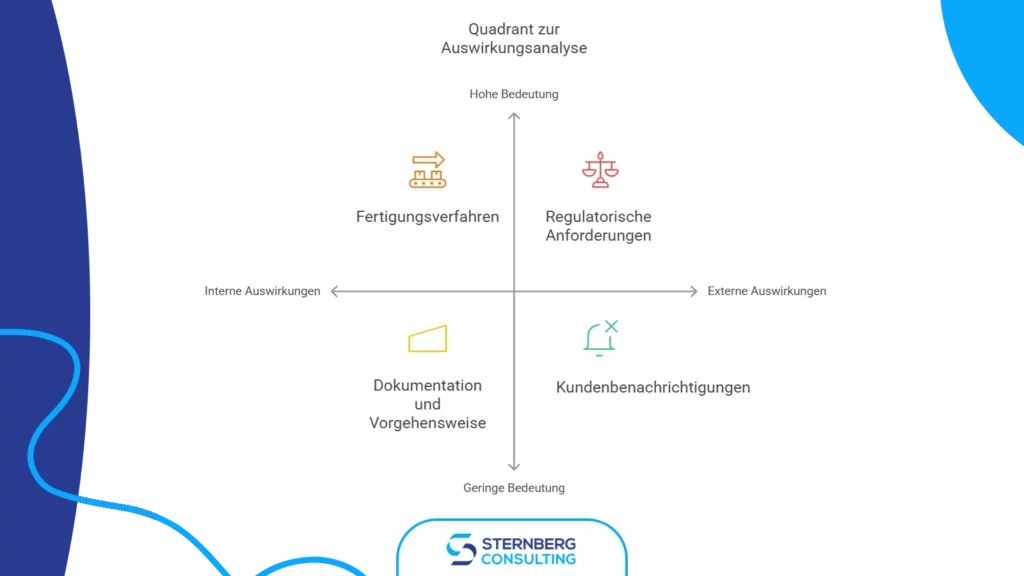
Die Auswirkungenanalyse bewertet, wie sich die vorgeschlagene Änderung auf verschiedene Aspekte des Produkts und des Unternehmens auswirkt. Dabei sollten folgende Punkte berücksichtigt werden:
- Andere Komponenten des Produkts
- Aktuelle Lagerbestände
- Marketingmaterialien
- Bereits auf dem Markt befindliche Geräte
- Kundenkommunikation
- Regulatorische Anforderungen
- Fertigungsprozesse
- Dokumentation und Verfahren
Ein interdisziplinäres Team aus Qualitätsmanagement, Regulierung, Technik, Produktion und Lieferkette sollte die Analyse durchführen, um alle relevanten Aspekte abzudecken.
3) Risikobewertung
Die Risikobewertung hilft Organisationen, die potenziellen Auswirkungen der vorgeschlagenen Änderung auf Produktsicherheit, Wirksamkeit und regulatorische Compliance zu verstehen.
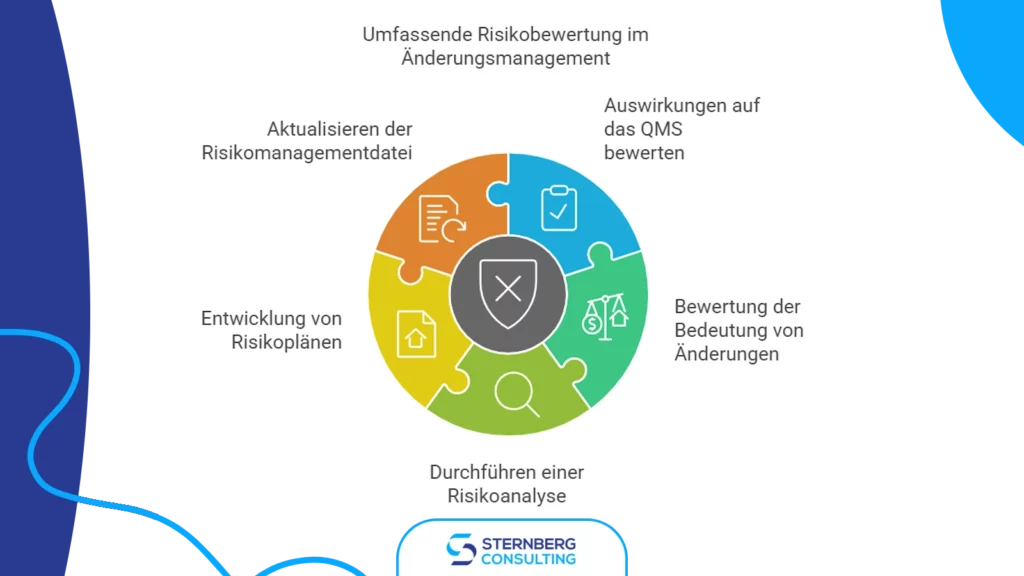
Wichtige Aspekte der Risikobewertung umfassen:
- Bewertung der Auswirkungen auf das QMS und die hergestellten Medizinprodukte
- Beurteilung der Änderung hinsichtlich Funktion, Leistung, Gebrauchstauglichkeit und Sicherheit
- Durchführung einer umfassenden Risikoanalyse
- Entwicklung und Implementierung von Maßnahmen zur Risikominderung
- Aktualisierung der Risikoakte des Produkts, falls erforderlich
4) Genehmigungsprozess und Umsetzung
Der Genehmigungsprozess stellt sicher, dass alle Änderungen ordnungsgemäß geprüft, validiert und implementiert werden.
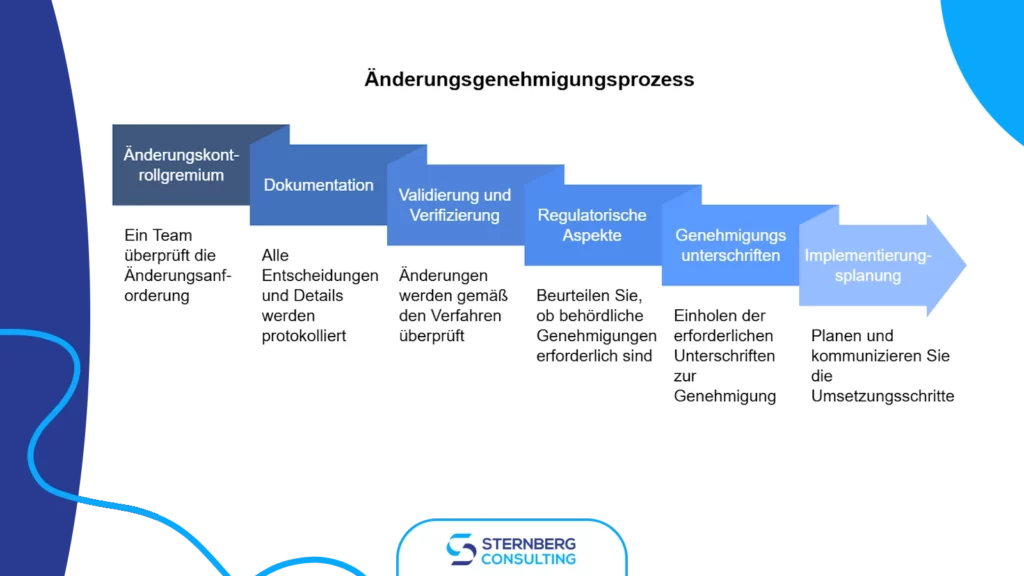
Schlüsselelemente eines effektiven Genehmigungsprozesses:
- Änderungskontrollausschuss (Change Control Board): Ein Team aus Vertretern verschiedener Abteilungen überprüft den Änderungsantrag und bewertet dessen Machbarkeit sowie Auswirkungen.
- Umfassende Dokumentation: Alle Entscheidungen im Zusammenhang mit der Änderung müssen dokumentiert werden, einschließlich detaillierter Erläuterungen zur Bewertung des Umfangs, der Auswirkungen, der verbundenen Risiken und der erforderlichen Maßnahmen.
- Validierung und Verifizierung: Änderungen müssen vor der Implementierung nach festgelegten Verfahren geprüft oder validiert werden.
- Regulatorische Anforderungen: Es muss geklärt werden, ob die Änderung behördliche Einreichungen oder Genehmigungen erfordert.
- Genehmigungssignaturen: Die Zustimmung durch relevante Verantwortliche ist erforderlich, einschließlich derjenigen, die die ursprüngliche Prüfung und Genehmigung der betroffenen Dokumente durchgeführt haben.
- Implementierungsplanung: Ein detaillierter Implementierungsplan mit Zeitrahmen muss erstellt und kommuniziert werden. Dabei sind Notfallmaßnahmen, Verantwortlichkeiten und Überwachungsprozesse zu berücksichtigen.
- Kommunikation und Schulung: Genehmigte Änderungen müssen zeitnah an alle relevanten Mitarbeiter kommuniziert werden. Schulungsunterlagen sollten aktualisiert und notwendige Schulungen durchgeführt werden, um eine effektive Umsetzung zu gewährleisten.
5) Nachverfolgung nach der Implementierung
Die Nachverfolgung nach der Implementierung stellt sicher, dass die Änderungen die gewünschten Ergebnisse erzielen, ohne neue Risiken oder negative Auswirkungen zu verursachen. Dieser Prozess dient der Validierung der Wirksamkeit der Änderung und der Einhaltung regulatorischer Anforderungen.
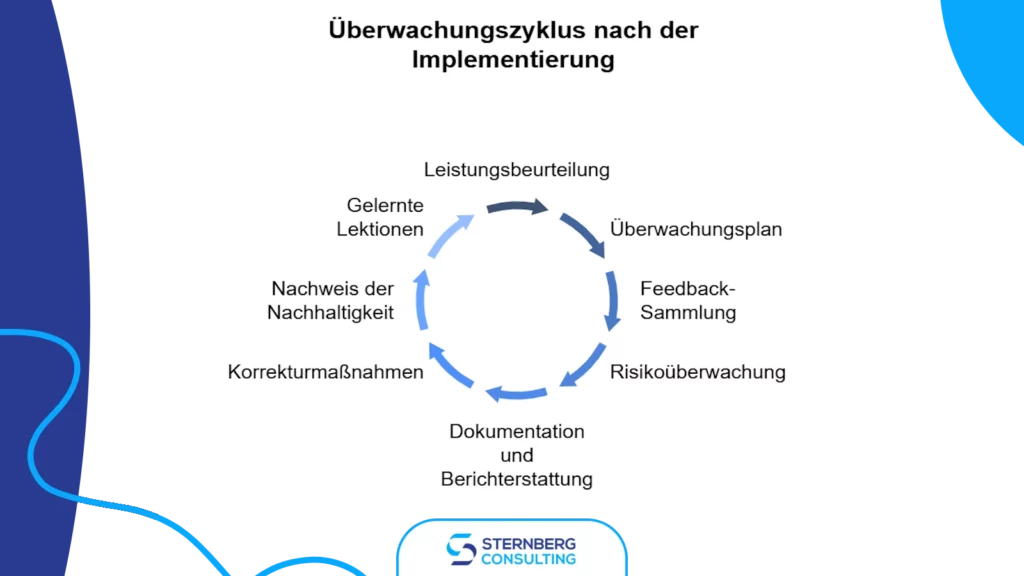
Wichtige Elemente der Nachverfolgung:
- Leistungsbewertung: Der Erfolg der Änderung wird anhand definierter Kennzahlen gemessen. Der aktuelle Leistungsstand wird mit Basiswerten verglichen, um Prozessverbesserungen zu bewerten.
- Überwachungsplan: Festlegung von Kontrollpunkten, Zeitplänen und Methoden zur Beobachtung der Auswirkungen der Änderung.
- Feedback-Erhebung: Einholung von Rückmeldungen von Stakeholdern und Kunden zur Identifizierung potenzieller Probleme oder Verbesserungsmöglichkeiten.
- Risikomonitoring: Neubewertung der mit der Änderung verbundenen Risiken und ggf. Aktualisierung der Risikomanagementakte.
- Dokumentation und Berichterstattung: Aufzeichnung von Erkenntnissen, Erfolgen und Herausforderungen sowie Erstellung von Berichten für das Management oder die Aufsichtsbehörden.
- Korrektur- und Vorbeugemaßnahmen (CAPA): Behebung von Nichtkonformitäten oder Problemen sowie Umsetzung von Maßnahmen zur Vermeidung einer Wiederholung.
- Nachhaltigkeitsprüfung: Implementierung eines langfristigen Validierungsplans zur Sicherstellung der nachhaltigen Wirksamkeit der Änderung.
- Erfahrungsrückfluss: Nutzung der gewonnenen Erkenntnisse zur Optimierung des Änderungskontrollprozesses und Verbesserung zukünftiger Initiativen.
6) Dokumentation und Rückverfolgbarkeit
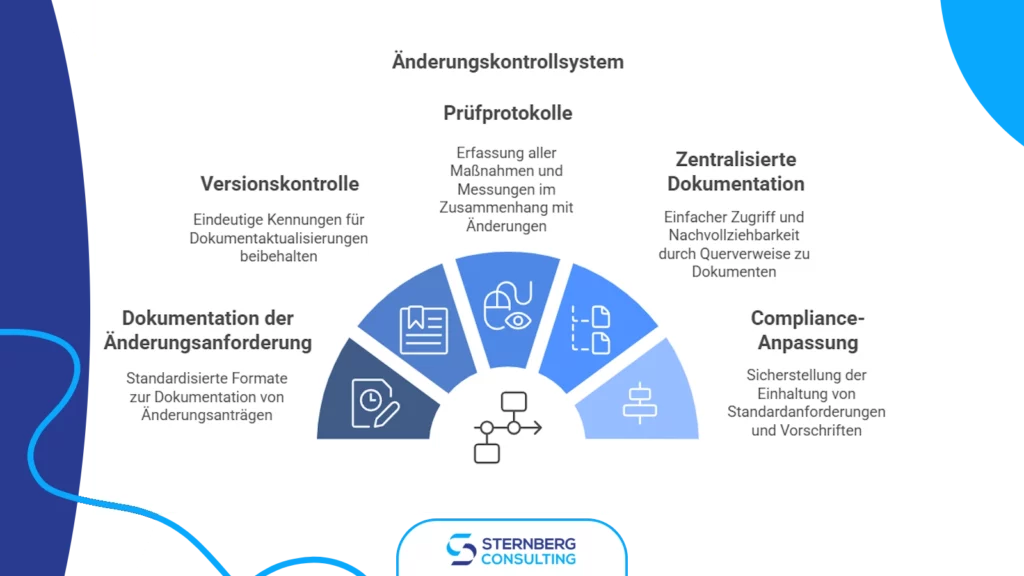
Eine ordnungsgemäße Dokumentation und Rückverfolgbarkeit sind das Fundament eines effektiven Änderungskontrollsystems. Sie gewährleisten Transparenz, Konformität und Verantwortlichkeit für jede vorgenommene Änderung.
Folgende Maßnahmen sollten umgesetzt werden:
- Standardisierte Dokumentation von Änderungsanträgen, z. B. in Design History Files (DHF), Device Master Records (DMR) oder Änderungsantragsformularen.
- Versionskontrolle mit eindeutigen Kennungen: Sicherstellung, dass Dokumente aktualisiert, rückverfolgbar und zugänglich bleiben.
- Klare Audit-Trails: Aufzeichnung aller durchgeführten Maßnahmen und Messungen im Zusammenhang mit der Änderung.
- Zentralisierte Dokumentation mit Querverweisen für einfachen Zugriff und Rückverfolgbarkeit.
- Abgleich mit relevanten Normen, wie ISO 13485, FDA 21 CFR Part 820 und der EU-MDR.
- Stakeholder-Zugriff und Kollaborationstools zur Prüfung und Genehmigung.
- Dokumentation des Änderungsabschlusses und Lessons Learned zur kontinuierlichen Verbesserung.
- Archivierungspolitik: Dokumente müssen entsprechend den organisatorischen Anforderungen und Qualitätsstandards aufbewahrt werden.
Durch die Integration dieser Schlüsselkomponenten in das Änderungskontrollsystem können Hersteller von Medizinprodukten Änderungen effizient verwalten und gleichzeitig die Einhaltung der ISO 13485 und FDA-Vorschriften sicherstellen. Dieser systematische Ansatz hilft, Risiken zu minimieren, die Produktqualität zu gewährleisten und die kontinuierliche Verbesserung in der sich ständig weiterentwickelnden Medizintechnikbranche zu fördern.
Wie man eine Änderungssteuerungsstrategie entwickelt
Um eine effektive Änderungssteuerungsstrategie zu etablieren, sollten Hersteller von Medizinprodukten sicherstellen, dass sie mit regulatorischen Anforderungen und bewährten Branchenpraktiken übereinstimmt. Diese Strategie sollte die Erstellung von Richtlinien, eine klare Rollenverteilung und ein umfassendes Schulungsprogramm umfassen.
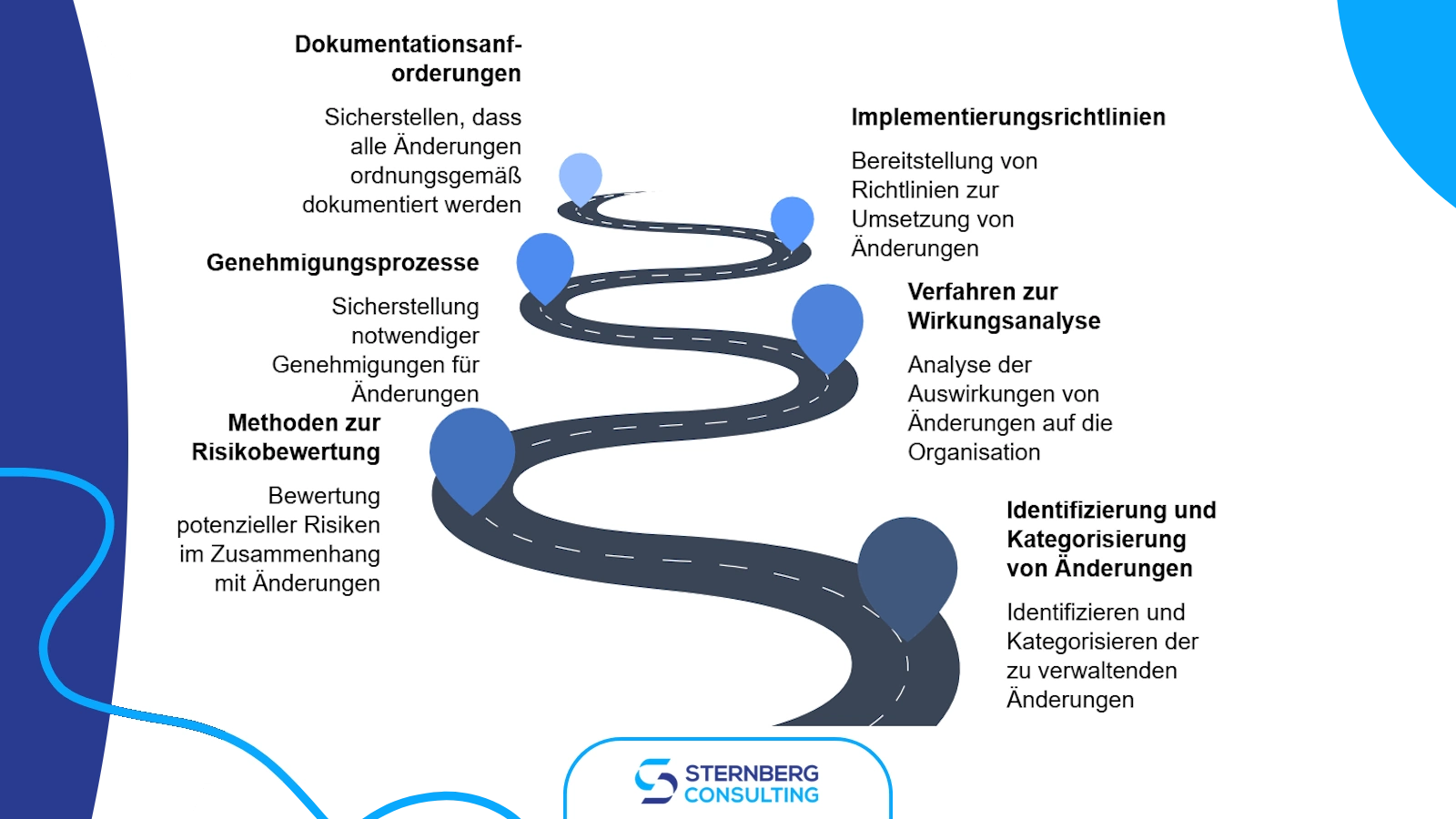
1) Erstellung von Richtlinien und Verfahren
Die Grundlage einer erfolgreichen Änderungssteuerungsstrategie liegt in klar definierten Richtlinien und Verfahren. Diese Dokumente sollten den Ansatz der Organisation zur Verwaltung von Änderungen an Produkten, Prozessen und Dokumentationen darlegen. Wichtige Elemente sind:
- Identifikation und Kategorisierung von Änderungen
- Methoden zur Risikobewertung
- Verfahren zur Auswirkungenanalyse
- Genehmigungsprozesse
- Umsetzungsrichtlinien
- Dokumentationsanforderungen
Der gesamte Änderungsmanagementprozess sollte mit einer Auswirkungenanalyse beginnen, selbst bei kleinen Änderungen, um deren Einfluss auf Produkte, Qualitätsprozesse und das Unternehmen als Ganzes zu verstehen.
The entire change management process should begin with an impact assessment, even for small changes, to understand the impact on products, quality processes, and the company as a whole.
2) Definition von Rollen und Verantwortlichkeiten
Die klare Definition von Rollen und Verantwortlichkeiten ist entscheidend für eine effektive Änderungssteuerung. Es sollte ein Änderungsausschuss („Change Control Board“) mit Mitgliedern aus verschiedenen Abteilungen wie Qualitätsmanagement, Technik, Lieferkette, Produktion und Buchhaltung eingerichtet werden. Zu den Aufgaben dieses Ausschusses gehören:
- Prüfung von Änderungsanträgen
- Bewertung potenzieller Auswirkungen und Risiken
- Entscheidungen über die Genehmigung oder Ablehnung von Änderungen
- Dokumentation der Entscheidungsgründe
Der Änderungsausschuss sollte regelmäßig (wöchentlich, zweiwöchentlich oder monatlich) zusammentreten, um eingereichte Änderungen zu überprüfen. Dabei werden Fragen zu Ressourcenbindung, Machbarkeit und wirtschaftlichem Nutzen der vorgeschlagenen Änderungen diskutiert.
3) Implementierung eines Schulungsprogramms
Ein umfassendes Schulungsprogramm ist essenziell, um sicherzustellen, dass alle beteiligten Mitarbeiter ihre Rollen und Verantwortlichkeiten im Änderungsmanagementprozess verstehen. Die Schulung sollte folgende Themen abdecken:
- Richtlinien und Verfahren zur Änderungssteuerung
- Techniken zur Risikobewertung
- Dokumentationsanforderungen
- Aspekte der regulatorischen Compliance
Alle relevanten Mitarbeiter, einschließlich Fachkräfte aus Qualitätsmanagement, Technik, Produktion und Management, sollten geschult werden. Regelmäßige Auffrischungskurse und Updates zu Änderungen im Änderungssteuerungsprozess sollten in das Schulungsprogramm integriert werden.
Best Practices zur Verbesserung der Änderungssteuerungsstrategie:
- Anwendung eines risikobasierten Ansatzes zur Bestimmung des erforderlichen Kontrollniveaus für verschiedene Arten von Änderungen.
- Implementierung eines stufenweisen („gated“) Ansatzes zur Änderungssteuerung, bei dem bestimmte Schritte abgeschlossen und genehmigt werden müssen, bevor die nächste Phase beginnt.
- Nutzung elektronischer Qualitätsmanagementsysteme (eQMS), um den Änderungssteuerungsprozess zu optimieren und die Rückverfolgbarkeit zu verbessern.
- Regelmäßige Überprüfung und Aktualisierung der Änderungssteuerungsstrategie, um deren kontinuierliche Wirksamkeit und Compliance mit sich entwickelnden regulatorischen Anforderungen sicherzustellen.
Fazit
Eine effektive Änderungssteuerung in ISO 13485 ist ein Grundpfeiler des Qualitätsmanagements für Unternehmen in der Medizintechnik. In der sich ständig weiterentwickelnden Medizingerätebranche kann die Bedeutung eines systematischen Ansatzes zur Änderungssteuerung nicht überschätzt werden. Ein gut strukturiertes Änderungsmanagementsystem in Verbindung mit umfassender Dokumentation und effektiver Kommunikation ermöglicht es Organisationen, komplexe regulatorische Anforderungen zu erfüllen und eine kontinuierliche Verbesserung voranzutreiben.
Sind Sie bereit, Ihr Qualitätsmanagement zu verbessern? Kontaktieren Sie uns jetzt, und lassen Sie uns gemeinsam Ihre ISO-Zertifizierungsziele erreichen!
FAQs
Welcher Abschnitt der ISO 13485 ist der Änderungssteuerung gewidmet?
Die ISO 13485 behandelt die Änderungssteuerung umfassend und integriert sie als Kernthema in den Standard. Im Gegensatz zu FDA 21 CFR 820 enthält die ISO 13485 einen spezifischen Abschnitt zur Änderungssteuerung: Abschnitt 4.1.4.
Welche Schritte umfasst ein Änderungsmanagementprozess?
Ein strukturierter Änderungsmanagementprozess umfasst fünf Phasen:
Was bedeutet Änderungssteuerung im Kontext von Medizingeräten?
Die Änderungssteuerung in der Medizingeräteindustrie ist ein systematischer Ansatz zur Verwaltung von Änderungen an einem Medizingerät oder seinen Produktionsprozessen. Dabei werden Änderungen bewertet, dokumentiert und genehmigt, um sicherzustellen, dass sie keine negativen Auswirkungen auf Sicherheit, Leistung oder regulatorische Zulassungen haben.
Wie läuft der Änderungssteuerungsprozess in der Pharmaindustrie ab?
Der Änderungssteuerungsprozess in der Pharmaindustrie umfasst in der Regel folgende Schritte:
- Einreichen eines Änderungsantrags
- Bewertung des Änderungsantrags
- Entwicklung einer Änderungsmanagementstrategie
- Umsetzung der Änderung
- Abschluss des Änderungsantrags
- Einreichen eines Änderungsantrags
- Durchführung einer Auswirkungenanalyse
- Prüfung des Änderungsantrags
- Genehmigung des Änderungsplans
- Umsetzung der Änderung
- Bereitstellung erforderlicher Schulungen (falls erforderlich)
- Überwachung der Wirksamkeit der Änderung
About the Author
Jonathan
Jonathan Sternberg, founder of Sternberg Consulting, brings extensive experience from the automotive, semiconductor, and optical industries. He focuses on customized solutions and genuine collaboration in quality management.